Espectro atomico
| Iste articlo ye en proceso de cambio enta la ortografía oficial de Biquipedia (la Ortografía de l'aragonés de l'Academia Aragonesa d'a Luenga). Puez aduyar a completar este proceso revisando l'articlo, fendo-ie los cambios ortograficos necesarios y sacando dimpués ista plantilla. |
O espectro d'emisión atomica d'un elemento quimico ye o conchunto de frecuencias d'as ondas electromagneticas emesas por atomos d'ixe elemento. O espectro d'emisión atomica de cada atomo ye unico y se puet fer servir ta determinar si ixe elemento fa parte d'un compuesto esconoixiu.
As caracteristicas d'o espectro d'emisión de bels elementos se veyen clarament cuan se fa calentar ixos elementos. Asinas, por eixemplo, cuan un filo de platino se banya en una solución de nitrato d'estroncio y dimpués se fica en una flama, os atomos d'estroncio emeten una color roya. D'a mesma traza, cuan l'arambre (u cobre) s'introduz en una flama, ísta se torna en luz verda. Pero no todas as luces emesas son visibles ta os uellos, que o espectro tamién incluye radiación ultravrioleta y infraroya. O espectro d'emisión atomica, incluindo a luz emesa en tot o rango de frecuencias (no nomás as visibles), permite caracterizar os elementos quimicos que fan parte d'un obchecto.
O feito que nomás bellas colors amaneixcan en as emisions d'os elementos significa que nomás s'emeten bellas frecuencias determinadas. Cadaguna d'istas frecuencias se relacionan con a enerchía por a formula:
en do E ye a enerchía, h ye a constant de Planck y ye a frecuencia. A frecuencia ye igual a: , en do c ye a velocidat d'a luz en o vueito y λ ye a longaria d'onda. Con isto se conclui que un atomo nomás puet emeter fotons con ciertas enerchías. O prencipio d'o espectro d'emisión atomica explican os resultaus d'as diferents colors d'as flamas debantditas.
As frecuencias de luz que un atomo puet emeter pende en os estaus en que os electrons pueden estar. Cuan s'excitan, os electrons se mueven enta una capa d'enerchía superior. Y cuan cayen dica a suya capa normal emeten a luz.
Un espectro d'emisión ye siempre complementario d'o suyo espectro d'absorción, que ye o que s'observa cuan a luz trescruza un gas. O espectro d'absorción ye contino y ye compuesto por todas as frecuencias fueras d'as que o gas puet absorber (que son as mesmas que fan o suyo espectro d'emisión).

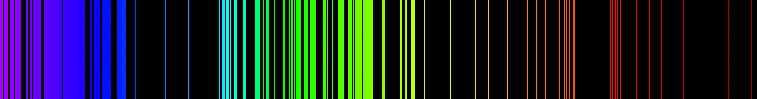
Balmer yera estudiando lo espectro d'absorción d'o hidrocheno en a zona d'o visible cuan trobó que bi heba bella relación entre as longarias d'onda d'as radiacions obtenidas. Asinas: {n>2}. Ista serie ye conoixida como a Serie de Balmer.
Alentau por la troballa de Balmer, Lyman estudeó lo espectro d'absorción d'o hidrocheno pero en a zona d'o ultravrioleta. O resultau estió a Serie de Lyman: {n>1}
Rydberg trobó una formula cheneral: {}, en do indica a zona de treballo (, ultravioleta;, bisible; , infraroyo...). En todas as formulas, R ye a Constant de Rydberg.
O Modelo atomico de Bohr contrimuestra l'orichen d'istos espectros.
Espectroscopía
[editar | modificar o codigo]A luz ye una radiación electromagnetica con diferents longarias d'onda. Asinas, cuan os elementos u os suyos compuestos se fan calentar en una flama u arco electrico, emeten enerchía en forma de luz. Si s'analiza ista luz, con aduya d'un espectroscopio, se troba un espectro discontino. Un espectroscopio u espectrometro ye un instrumento que se fa servir ta deseparar as components d'a luz que tienen diferents longarias d'onda. O espectro ye composau d'una serie de linias que se clama espectro de linias. A iste espectro de linias se le diz espectro atomico porque tien o suyo orichen en o elemento y ye caracteristico d'o mesmo. O feito que o espectro d'os atomos d'un elemento siga un espectro de linias indica que un atomo nomás puet radiar bellas cantidaz determinadas d'enerchía. Isto mena t'a conclusión que os electrons no pueden tener cualsiquier cantidat d'enerchía si que nomás ciertas cantidaz d'enerchía.
O espectro d'emisión se puet fer servir ta determinar as composición d'un material, pos ye diferent ta cada elemento quimico d'a tabla periodica. Un eixemplo d'ista aplicación ye a espectroscopía astronomica, que fa que se pueda identificar a composición d'os estrels analizando-ne a luz recibida.
Espectro d'absorción
[editar | modificar o codigo]Cuan a luz trescruza un gas, os atomos u moleculas d'o gas absorben a luz que tienga as suyas frecuencias caracteristicas. Dimpués tornarán a emeter ixa luz, emetendo fotons en unatra dirección. O espectro d'a luz que ha pasau por un gas tendrá linias escuras (ye decir, li faltarán ixas frecuencias d'o espectro) correspondients a las frecuencias caracteristicas d'o gas. O patrón de linias escuras, conoixiu como espectro d'absorción, ye o complementario d'o espectro d'emisión.











